The chemical element hafnium is classed as a transition metal . It was discovered in 1923 by Georg von Hevesy and Dirk Coster.

Data Zone
| Classification: | Hafnium is a transition metal |
| Color: | silvery |
| Atomic weight: | 178.,49 |
| State: | solid |
| Melting point: | 2230 oC, 2503 K |
| Boiling point: | 4600 oC, 4873 K |
| Electrons: | 72 |
| Protons: | 72 |
| Neutrons in most abundant isotope: | 108 |
| Electron shells: | 2,8,18,32,10,2 |
| Electron configuration: | 4f14 5d2 6s2 |
| Density @ 20oC: | 13.,2 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 13.6 cm3/mol |
| Structure: | hcp: hexagonal close pkd |
| Hardness: | 5.5 mohs |
| Specific heat capacity | 0.14 J g-1 K-1 |
| Heat of fusion | 27.2 kJ mol-1 |
| Heat of atomization | 621 kJ mol-1 |
| Heat of vaporization | 575.,0 kJ mol-1 |
| 1st ionization energy | 658.5 kJ mol-1 |
| 2nd ionization energy | 1440 kJ mol-1 |
| 3rd ionization energy | 2250 kJ mol-1 |
| Electron affinity | 178 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 1.,3 |
| polariserbarhed volumen | 16.,none |
| Oxide(s) | HfO2 |
| Hydride(s) | HfH2 |
| Chloride(s) | HfCl4 |
| Atomic radius | 155 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 23.,2 W m-1 K-1 |
| Elektriske ledningsevne | 3,4 x 106 S m-1 |
| Frysning/Smeltepunkt: | 2230 oC, 2503 K |

Hafnium er en sølv farve. Det forekommer normalt ret gråt på grund af det o .idlag, det danner i luft. Hafniumpulver, uden o .idlaget, kan antændes spontant i luften. Billede Ref., (1)
opdagelse af Hafnium
hafniums eksistens blev oprindeligt forudsagt af den russiske kemiker Dmitri Mendeleev. I sin 1869 bog” den periodiske lov af de kemiske elementer ” forudsagde han eksistensen af et element med lignende egenskaber til, men tungere end Titan og .irconium.
i 1911 troede Georges Urbain, opdageren af den sjældne jordart lutetium, at han havde opdaget element 72 under sin spektrale analyse af sjældne jordarter. Han kaldte dette nye element celtium, men tre år senere viste det sig at være en blanding af allerede opdagede lanthanider., (2)
i 1921 foreslog Neils Bohr den ungarske kemiker Georg von Hevesy at kigge efter det manglende element i .irconiummalm. (3) ifølge Bohr ‘ s quantumuantum teori om atomare struktur, ville disse metaller har lignende kemiske egenskaber, så der var en god chance for de ville blive fundet i de samme malme.efter Bohrs råd opdagede Hevesy og den hollandske fysiker Dirk Coster hafnium i 1923 ved hjælp af røntgenspektroskopi til at analysere .irconiummalm.
Anton Eduard van Arkel og Jan Hendrik de Boer opdagede en metode til fremstilling af hafnium med høj renhed i 1925., Hafnium tetraiodid (HfI4) nedbrydes på en hvid varm filamentolframfilament skaber en krystal bar af ren hafnium. Dette er kendt som krystalstangprocessen.elementet blev kaldt Hafnium efter det latinske navn ‘Hafnia’, hvilket betyder København, byen hvor elementet blev opdaget.

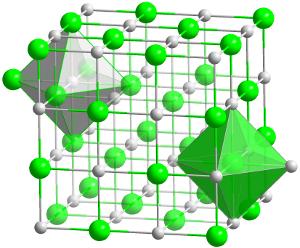
krystalstruktur af hafnium hårdmetal (HfC)., Dette er den mest ildfaste (varmebestandige) forbindelse kendt af to elementer i forholdet 1:1.

Hafnium, der anvendes i styrestænger i nukleare ubåde

Hvid hafnium (IV) oxid (HfO2). Hafniumo .idbaserede forbindelser indføres i siliciumchips for at producere mindre, højtydende processorer med forbedret energieffektivitet.,
udseende og egenskaber
skadelige virkninger:
Hafnium anses for at være ikke-toksisk. I pulverform er det pyroforisk (kan antændes spontant).
egenskaber:
Hafnium er et skinnende, sølvfarvet, duktilt metal.
kemisk svarer det til .irconium.
Når den er til stede i forbindelser, hafnium findes for det meste i oxidationstrin IV.
Hafnium modstår korrosion på grund af dannelsen af en oxid film på udsatte overflader.
det er upåvirket af alle syrer (bortset fra hydrogenfluorid) og alle alkalier.,
Hafnium reagerer med halogenerne for at danne tetrahalider, og ved høje temperaturer reagerer det med kulstof, bor, nitrogen, o .ygen, silicium og svovl.
anvendelser af Hafnium
Hafnium anvendes til atomreaktorstyrestænger på grund af dets evne til at absorbere neutroner og dets gode mekaniske og korrosionsbestandighedskvaliteter. Dette er i fuldstændig kontrast til hairconium, som selv om det kemisk er meget lig hafnium, er meget dårlig til at absorbere neutroner., Thereforeirconium bruges derfor i beklædningen (ydre lag) af brændstofstænger, hvorigennem det er vigtigt, at neutroner let kan rejse.
Hafnium anvendes også i fotografiske flash pærer, pære filamenter, og i elektronisk udstyr som katoder og kondensatorer.
Hafniumlegeringer med flere andre metaller, såsom jern, niobium, tantal og Titan.
Hafnium-niobiumlegeringer er for eksempel varmebestandige og anvendes i rumfartsapplikationer, såsom rumraketmotorer.,
Hafniumcarbid bruges til at lineere højtemperaturovne / ovne på grund af dets ildfaste egenskaber (det smelter ikke ved høje temperaturer).
hafnium-baserede forbindelser anvendes i gate isolatorer i 45 nm generation af integrerede kredsløb til computere.
hafniumo .id-baserede forbindelser indføres i silicium-baserede chips til at producere mindre, mere energieffektive og ydeevne pakket processorer(4).
overflod og isotoper
overflod jordskorpen: 3,3 dele pr.million efter vægt, 0.,4 dele per million af mol
Overflod solar system: 1 del pr milliarder af vægt, 0.01 parts per billion af mol
Omkostninger, rene: $120 per 100g
Omkostninger, bulk: $ per 100g
Kilde: Hafnium findes ikke frie i naturen, men er fundet i de fleste zirkonium-mineraler i en koncentration på mellem én og fem procent. Kommercielt fremstilles hafnium som et biprodukt af refiningirconiumraffinering. Dette gøres ved hjælp af Kroll-processen, hvilket reducerer tetrachlorid med magnesium eller med natrium.,

- Foto af Deglr6328
- Per Enghag, behandling af Elementer: Tekniske Data – Historie – Behandling – Applikationer, 2008, John Wiley & Sønner, p527.
- Bob Bobeintraub, George de Hevesy (1885 1966) (pdf-dokument).
- Aile Tamm, Atomlagaflejring af Højpermittivitetsisolatorer fra Cyclopentadienylbaserede forstadier, 2010, Tartu University Press, P18.,
Cite denne Side
For online sammenkædning, skal du kopiere og indsætte følgende:
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium</a>
eller
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium Element Facts</a>
for At nævne denne side i en akademisk dokument, skal du bruge følgende MLA-kompatibel citat:
"Hafnium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hafnium.html>.