Termodynamik er en gren af physicswhich beskæftiger sig med energi og arbejde i et system.Termodynamikken beskæftiger sig kun med et system med stor skala, som vi kan observere og måle i forsøg. Småskala gasinteraktioner erbeskrevet af den kinetiske teori om gasser.Der er tre principalla .s af termodynamik, som er beskrevet på separate dias., Hverlov fører til definitionen aftermodynamiske egenskabersom hjælper os med at forstå og forudsige driften af et fysisksystem. Vi vil præsentere nogle enkle eksempler på disse love ogegenskaber for en række fysiske systemer, selv omvi er mest interesserede i termodynamikken afpropulsionssystemeroghøj hastighed strømme.Heldigvis er mange af deklassiske eksempler på termodynamik involverer gasdynamik.,
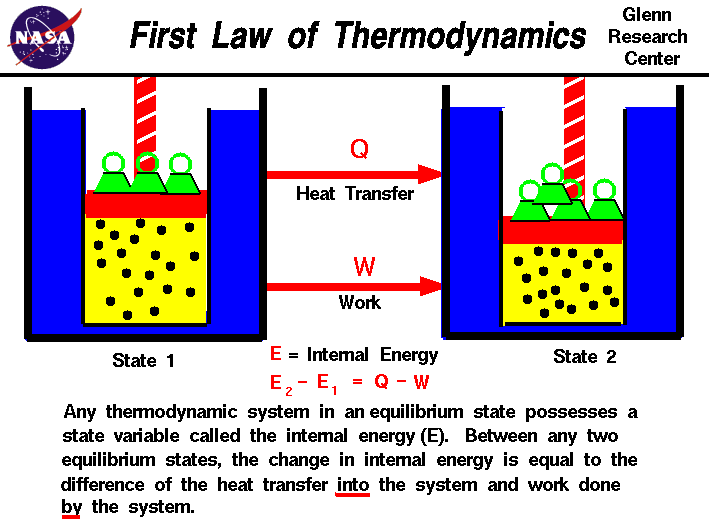
i vores observationer af det arbejde,der udføres på eller af en gas, har vi fundet, at mængden af arbejde ikke kun afhænger afpå gasens indledende og endelige tilstandmen også på processen eller stien, der producerer den endelige tilstand.Tilsvarende afhænger mængden af varme, der overføres til eller fra en gas, også af de indledende og endelige tilstande og den proces, der producerer den endelige tilstand., Mange observationer af ægtegasser har vist, at forskellen i varmestrømmen ind i gasenog gasens arbejde afhænger kun af gassens indledende og endeligestater og afhænger ikke af processen eller stiensom producerer den endelige tilstand. Dette tyder på eksistensen af enyderligere variabel, kaldet gasens indre energi, som kun afhænger af gasens tilstand og ikke på nogen proces.Den indre energi er en tilstandsvariabel, ligesom temperaturen ellertrykket., Den første lov om termodynamik definerer det interneenergi (e) som lig med forskellen mellem varmeoverførslen ()) i et system og det arbejde (.), der udføres af systemet.
E2 – e1 = <
Vi har understreget ordene “til” og “af” i definitionen. Varme fjernet fra et systemville blive tildelt et negativt tegn i ligningen. Tilsvarende workorkdone på systemet er tildelt et negativt tegn.,
den indre energi er bare en form for energi som potentialenergien af et objekt i en eller anden højde over jorden eller kineticenergien af et objekt i bevægelse. På samme måde som potentiel energi kan omdannes til kinetisk energi og samtidig bevare systemets samlede energi, kan den indre energi i et termodynamisk system konverteres til enten kinetisk eller potentiel energi. Ligesom potentialeenergi kan den interne energi opbevares i systemet.Bemærk dog, at varme og arbejde ikke kan opbevares eller bevares uafhængigt, da de afhænger af processen., Den første lov om termodynamik tillader mangemulige tilstande i et system at eksistere, men kun visse stater findes i naturen. Den anden lov af termodynamik hjælper medforklare denne observation.
Hvis et system er fuldt isoleret fra det ydre miljø, er det muligt at ændre tilstanden, hvor der ikke overføres varme til systemet. Forskere henviser til en proces, der ikke involverer varmeoverførsel som en adiabatisk proces.,Gennemførelsen af den første lov om termodynamik for gasser introducerer anotheruseful state variabel kaldet enthalpywhich er beskrevet på en separat side.
Aktiviteter:
Guidede Ture
-
 Termodynamik:
Termodynamik: 
Navigation ..
![]()
![]()
![]()
Beginner ‘ s Guide Startside