en katalysator er et stof, der fremskynder en kemisk reaktion, men forbruges ikke af reaktionen; derfor kan en katalysator udvindes kemisk uændret i slutningen af den reaktion, den er blevet brugt til at fremskynde eller katalysere.

Diskussion
for at kemikalier skal reagere, skal deres bindinger omarrangeres, fordi bindingerne i produkterne er forskellige fra dem i reaktanterne.,Det langsomste trin i bindingsomlægningen producerer det, der kaldes en overgangstilstand-en kemisk art, der hverken er et reaktant eller et produkt, men er et mellemprodukt mellem de to.
energi kræves for at danne overgangstilstanden. Denne energi kaldes aktiveringsenergien eller Ea.Læsning af diagrammet nedenfor fra venstre mod højre viser udviklingen i en reaktion, når reaktanter passerer gennem overgangstilstanden for at blive produkter.,
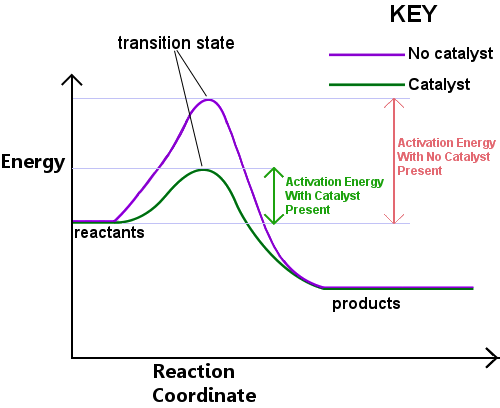
aktiveringsenergien kan betragtes som en barriere for en kemisk reaktion, en forhindring, der skal krydses.Hvis barrieren er høj, har få molekyler tilstrækkelig kinetisk energi til at kollidere, danne en overgangstilstand og krydse barrieren.Reaktanter med lavere energi end Ea kan ikke passere gennem overgangstilstanden for at reagere og blive produkter.
en katalysator virker ved at tilvejebringe en anden rute, med lavere Ea, for reaktionen. Katalysatorer sænker energibarrieren.,Den anden rute giver bond-rearrangementer er nødvendig for at konvertere reaktanter til produkter, der finder sted mere let, med et lavere energiforbrug.I et givet tidsinterval, tilstedeværelse af en katalysator giver en større andel af reaktant-arter at afhente tilstrækkelig energi til at passere gennem overgangen staten og bliver til produkter.eksempel 1: Haber-processen
Haber-processen, der bruges til at fremstille ammoniak fra hydrogen og nitrogen, katalyseres af jern, hvilket tilvejebringer atomsteder, hvorpå reaktantbindingerne lettere kan omarrangere for at danne overgangstilstanden.,
Eksempel 2: Enzymer
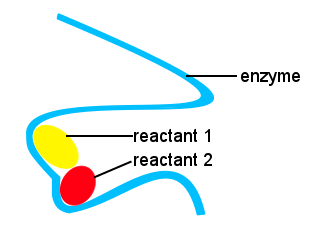
I vores kroppe, og i andre levende ting, enzymer er brugt til at fremskynde biokemiske reaktioner. Et en .ym er en type katalysator.Komplekst liv ville være umuligt uden en .ymer for at tillade reaktioner at finde sted med passende hastigheder.Formerne af en .ymer sammen med placeringer på en .ymet, der binder til reaktanterne, tilvejebringer en alternativ reaktionsvej, der tillader specifikke molekyler at komme sammen for at danne en overgangstilstand med en reduceret aktiveringsenergibarriere.,
i det skematiske nedenfor tilvejebringer en .ymet langkædede steder, hvor reaktantmolekyler samles for at danne en overgangstilstand med en lav aktiveringsenergi.
katalysatorer kan ikke ændre positionen for en kemisk ligevægt – frem-og tilbagereaktionerne accelereres begge, så ligevægtskonstanten Ke.er uændret.Ved at fjerne produkter fra reaktionsblandingen, når de dannes, kan den samlede produktdannelseshastighed i praksis øges.