Dovednosti Rozvíjet
- Pochopit, proč Lavoisier je někdy nazýván „Otec Moderní Chemie“
- Odlišit přesnosti od přesnosti
Takže to, co se vám stalo, že alchymie, která byla jako kouzelný lektvar-vaření v Harry Potterovi, do vědy chemie? Bylo to měření. Pečlivé a pečlivé měření veličin, jako jsou hmotnosti, objemy, hustoty, teploty, tlaky.
raným hrdinou měření byl Antoine Lavoisier., Byl jedním z prvních skutečných chemických vědců. Prováděl pečlivé experimenty a snažil se vyvodit žádné závěry kromě těch, které vyžadují jeho data. Řekl, že skutečnost, myšlenka a slovo by měly být co nejblíže spojeny: že nemůžete zlepšit svůj jazyk bez zlepšení svého myšlení a nemůžete zlepšit své myšlení bez zlepšení jazyka. Propagoval tedy systematickou chemickou nomenklaturu, která je v podstatě to, co dnes používáme., Je pozoruhodné, že pokud si přečtete jeho text, napsaný v roce 1789, který má za cíl představit chemii začátečníkům, je většina z nich stále dokonale srozumitelná a dokonce správná moderními standardy.
.jpg?revision=1&size=bestfit&width=200&height=272)
Lavoisier nejprve popisuje stavy hmoty: plyny, kapaliny a pevné látky. Poukazuje na to, že když se zahřeje pevný materiál, má tendenci se rozšiřovat a stává se nejprve kapalinou, která zabírá konstantní objem, ale může být nalita, na rozdíl od pevné látky., Více topení, a to se stává plyn, který popisuje jako elastický, protože se bude rozšiřovat nebo komprimovat do různých objemů v závislosti na tlaku. Na rozdíl od řeckých filozofů, pochopil, že tohle je fyzická změna, ne chemická změna, a on má dobrý submikroskopické měřítku intuici, co se děje: částice materiálu se nemění, jen se dále od sebe.,
spálil síry a fosforu a dřevěné uhlí (uhlík) a pečlivé pozorování, často za použití bell jar přes kbelík rtuť, jak je znázorněno ve výkresu z jeho knihy, viz Obrázek 1. Jedná se o příklad chemické změny nebo chemické reakce, při které se reakční chemikálie mění na různé chemikálie produktu. Pokud zapálíte síru v misce označené D pod zvonkovou nádobou vzduchu, spálí se, dokud nevyjde a nezanechá další síru. Vzduch, který zůstává v nádobě, již není vhodný pro dýchání. Pokud dáte myš do nádoby, zemře, stejně jako plamen., To demonstruje koncept omezení reaktantu. Reakce nebo pálení se zastavily, když došel kyslík, přičemž v nádobě zůstal především dusík (a několik dalších stopových plynů). Priestley, další vědec, mu ukázal, jak připravit čistý kyslíkový plyn, a použil to k mnoha experimentům s pálením.
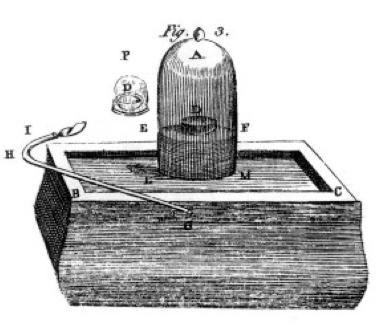
Lavoisier byl posedlý měřením., Vyvinul propracovaný přístroj pro měření všeho. Spaloval fosfor, jak je znázorněno na obrázku 1, a pozoroval tvorbu bílého vločkového produktu. Fosfor (reaktantů, v tomto případě) nebyl rozpustný ve vodě, ale produkt byl, tak sbíral produktu velmi pečlivě, oddělení od nezreagovaných fosforu mytí s vodou. Po vysušení mohl měřit, kolik fosforu spálilo, kolik kyslíku bylo spotřebováno (protože znal hustotu kyslíkového plynu) a kolik produktu se vytvořilo., Zjistil, že hmotnost produktu je součtem spotřebovaných hmot reaktantu v každém experimentu. Toto je zákon zachování hmoty (který ve skutečnosti použili i někteří dřívější alchymisté a chemici). Poznamenal také, že fosfor nemá chuť, ale produkt, který nazval kyselinou fosforečnou, je kyselý. Z těchto experimentů věděl, že v mnoha případech se prvky kombinují pouze v určitých poměrech a také že kyslík se může kombinovat se sírou, fosforem atd. ve dvou různých poměrech., Dal nám terminologii, kterou dnes stále používáme: kyselina sírová se skládá ze síry a více kyslíku, kyselina sírová se skládá ze síry a méně kyslíku. -ous znamená méně kyslíku; – ic znamená více kyslíku. Podrobnosti naleznete na stránce nomenklatury.
Lavoisier věnoval velkou pozornost přesnosti a přesnosti. Například, v experimentu, který jsme právě popsali, se měří objem plynu v jar bell, před a po reakci, ale poznamenal, že po reakci, musíte počkat, až se teplota vrátí k tomu, jaké to bylo, když jsi měřila původně., Pokud je plyn horký, když změříte jeho objem po reakci, rozšíří se a vaše standardní hustota se nepoužije. To by zavedlo systematickou chybu v měření: pokaždé, když provedete experiment, budete si myslet, že zbývá více plynu, než ve skutečnosti existuje, a vaše měření nebude přesné. Pokud je průměrný výsledek vašeho experimentu blízko správné hodnoty, je přesný. Pokud však váš experiment pokaždé dává velmi odlišná čísla, i když je průměr správný a experiment je přesný, není přesný., Přesnost je rozdíl mezi setkáním “ kolem 2 hodin „a setkáním“ ve 3 minutách a 27 sekund před 2 hod.“Přesnost je, jak jste konkrétní, kolik detailů používáte. Lavoisier také pomohl vyvinout systém jednotek (kg, L, m), které se v současné době používají v Koreji a mnoha dalších zemích.

Celkově, zatímco on neudělal velmi mnoho originálních experimentů, které nikdo jiný to udělal předtím, on dělal jeho experimentů velmi opatrně, aby byly správné a přesné, jak je to možné, a pak si myslel, že o nich jasně a vytvořil slova k popisu chemických látek a nápady, které pomohly, aby vše jasnější., Pokud budete číst učebnice chemie napsán před Lavoiser, bude velmi zmatený, protože názvy pro chemické látky by na základě historie (a bude znít, jako by přišel z Harryho Pottera), spíše než na základě toho, co chemikálie jsou. Pokud čtete text chemie napsaný po Lavoiseru, rozpoznáte jazyk jako podobný tomu, co dnes používáme.
souhrn
přesnost popisuje, jak blízko je naměřená hodnota ke skutečné hodnotě. Přesnost popisuje, jak dobře se skupina naměřených hodnot vzájemně souhlasí., Zákon zachování hmoty uvádí, že hmota nemůže být vytvořena ani zničena chemickým nebo fyzikálním procesem. To má za následek součet hmotností reaktantu spotřebovaného v jakémkoli experimentu se rovná hmotnosti produktu. Chemické změny zahrnují změnu chemické identity látky tak, aby se vytvořily nové látky. Fyzikální změny zahrnují změnu látky bez změny její chemické identity. Spalování a rezivění jsou dva příklady chemických procesů při varu a tavení jsou příklady fyzikálních procesů., Chemické reakce zahrnují soustružení reaktanty chemické látky, které se spotřebované v procesu chemické změny, na výrobky, chemikálie vyrobené procesem chemické změny, které mají různé složení z reaktantů. Omezující reaktant určuje nebo omezuje množství produktu, které může být vyrobeno z chemické reakce.
Odkaz
- CrashCourse Chemie: Základní Práva (11 min)
Přispěvatelé a Pravomocí
-
Emily V Eames (City College of San Francisco)