The chemical element hafnium is classed as a transition metal . It was discovered in 1923 by Georg von Hevesy and Dirk Coster.

Data Zone
| Classification: | Hafnium is a transition metal |
| Color: | silvery |
| Atomic weight: | 178.,49 |
| State: | solid |
| Melting point: | 2230 oC, 2503 K |
| Boiling point: | 4600 oC, 4873 K |
| Electrons: | 72 |
| Protons: | 72 |
| Neutrons in most abundant isotope: | 108 |
| Electron shells: | 2,8,18,32,10,2 |
| Electron configuration: | 4f14 5d2 6s2 |
| Density @ 20oC: | 13.,2 g/cm3 |
Show more, including: Heats, Energies, Oxidation,
Reactions, Compounds, Radii, Conductivities
| Atomic volume: | 13.6 cm3/mol |
| Structure: | hcp: hexagonal close pkd |
| Hardness: | 5.5 mohs |
| Specific heat capacity | 0.14 J g-1 K-1 |
| Heat of fusion | 27.2 kJ mol-1 |
| Heat of atomization | 621 kJ mol-1 |
| Heat of vaporization | 575.,0 kJ mol-1 |
| 1st ionization energy | 658.5 kJ mol-1 |
| 2nd ionization energy | 1440 kJ mol-1 |
| 3rd ionization energy | 2250 kJ mol-1 |
| Electron affinity | 178 kJ mol-1 |
| Minimum oxidation number | 0 |
| Min. common oxidation no. | 0 |
| Maximum oxidation number | 4 |
| Max. common oxidation no. | 4 |
| Electronegativity (Pauling Scale) | 1.,3 |
| polarizovatelnost | 16.,none |
| Oxide(s) | HfO2 |
| Hydride(s) | HfH2 |
| Chloride(s) | HfCl4 |
| Atomic radius | 155 pm |
| Ionic radius (1+ ion) | – |
| Ionic radius (2+ ion) | – |
| Ionic radius (3+ ion) | – |
| Ionic radius (1- ion) | – |
| Ionic radius (2- ion) | – |
| Ionic radius (3- ion) | – |
| Thermal conductivity | 23.,2 W m-1 K-1 |
| Elektrická vodivost | 3,4 x 106 S m-1 |
| Zmrazování/Tání: | 2230 ° c, 2503 K |

kovové Hafnium je stříbrné barvy. Obvykle se zdá být spíše šedá kvůli oxidové vrstvě, kterou tvoří ve vzduchu. Hafnium prášek, bez vrstvy oxidu, se může spontánně vznítit ve vzduchu. Obrázek Ref., (1)
objev Hafnia
Hafnia byl původně předpovězen ruským chemikem Dmitrijem Mendeleevem. V jeho 1869 knize „Periodický Zákon Chemických Prvků“ předpověděl existenci prvku s podobnými vlastnostmi, ale těžší než titan a zirkonium.
v roce 1911 si Georges Urbain, objevitel Lutecia vzácných zemin, myslel, že objevil prvek 72 během spektrální analýzy vzácných zemin. Nazval tento nový prvek celtium, ale o tři roky později to bylo prokázáno, že směs již objeveny lanthanoidy., (2)
V roce 1921, Neils Bohr navrhl maďarský chemik Georg von Hevesy, aby podívejte se na chybějící prvek v zirkonu rud. (3) Podle Bohrovy kvantové teorie atomové struktury by tyto kovy měly podobné chemické vlastnosti, takže byla velká šance, že by byly nalezeny ve stejných rud.
Následující Bohr poradenství, Hevesy a holandský fyzik Dirk Coster objevil hafnium v roce 1923 pomocí x-ray spektroskopie analyzovat zirkonia rud.
Anton Eduard van Arkel a Jan Hendrik de Boer objevili v roce 1925 metodu výroby hafnia s vysokou čistotou., Hafnium tetraiodid (HfI4) se rozkládá na bílém horkém wolframovém vlákně, které vytváří křišťálovou tyčinku čistého hafnia. To je známé jako proces crystal bar.
prvek byl nazýván Hafnium po latinském názvu „Hafnia“, což znamená Kodaň, město, kde byl prvek objeven.

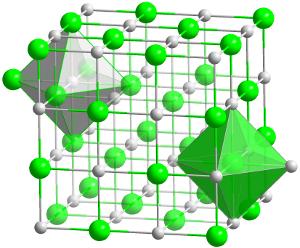
krystalová struktura hafnia karbidu (HfC)., Jedná se o nejvíce žáruvzdornou (tepelně odolnou) sloučeninu známou z jakýchkoli dvou prvků v poměru 1:1.

Hafnia se používá v jaderném reaktoru kontrolní tyče v jaderných ponorek,

Bílá hafnia (IV) oxid (HfO2). Sloučeniny na bázi oxidu hafnia se zavádějí do křemíkových čipů pro výrobu menších, vysoce výkonných procesorů se zlepšenou energetickou účinností.,
vzhled a vlastnosti
škodlivé účinky:
Hafnium je považováno za netoxické. V práškové formě je pyroforická (může se spontánně vznítit).
charakteristika:
Hafnium je lesklý, stříbřitý, tvárný kov.
chemicky je podobný zirkonu.
Pokud je přítomen v sloučeniny hafnia, existuje většinou v oxidačním stavu IV.
Hafnia odolává korozi v důsledku tvorby oxid film na exponované povrchy.
není ovlivněna všemi kyselinami (kromě fluorovodíku) a všemi zásadami.,
Hafnium reaguje s halogeny za vzniku tetrahalidů a při vysokých teplotách reaguje s uhlíkem, borem, dusíkem, kyslíkem, křemíkem a sírou.
použití Hafnia
Hafnia se používá pro řídicí tyče jaderných reaktorů kvůli své schopnosti absorbovat neutrony a dobrým mechanickým a korozním vlastnostem. To je v naprostém kontrastu s zirkoniem, který je sice chemicky velmi podobný hafniu, ale je velmi špatný při absorpci neutronů., Zirkonium se proto používá v opláštění (vnější vrstvě) palivových tyčí, kterými je důležité, aby neutrony mohly snadno cestovat.
Hafnium se také používá ve fotografických žárovkách, vláknech žárovek a v elektronických zařízeních jako katody a kondenzátory.
slitiny Hafnia s několika dalšími kovy, jako je železo, niob, tantal a Titan.
například slitiny Hafnia-niobu jsou odolné vůči teplu a používají se v leteckých aplikacích, jako jsou kosmické raketové motory.,
karbid Hafnia se používá k vedení vysokoteplotních pecí / pecí díky svým žáruvzdorným vlastnostem (při vysokých teplotách se neroztaví).
sloučeniny na bázi Hafnia se používají v izolátorech brány v generaci integrovaných obvodů 45 nm pro počítače.
Hafnium oxidů na bázi sloučenin jsou zaváděny do silicon-based čipy vyrábět menší, více energie, efektivní a výkon balené procesory(4).
hojnost a izotopy
hojnost zemské kůry: 3,3 dílů na milion hmotnostních, 0.,4 dílů na milion a na moly,
Množství sluneční soustavě: 1. část za miliardy hmotnostních, 0.01 ppb od molů
Náklady, čisté: $120 na 100 g
Náklady, objem: $ za 100 g
Zdroj: Hafnium není nalezen zdarma v přírodě, ale je nalezený ve většině zirkonia minerálních látek v koncentraci od jednoho do pěti procent. Komerčně se hafnium vyrábí jako vedlejší produkt rafinace zirkonia. To se provádí pomocí procesu Kroll, čímž se tetrachlorid redukuje hořčíkem nebo sodíkem.,

- Foto Deglr6328
- Za Enghag, Encyklopedie Prvky: Technické Údaje – Historie – Zpracování Žádosti, 2008, John Wiley & Syny, p527.
- Bob Weintraub, George De Hevesy (1885 1966) (PDF dokument).
- Aile Tamm, ukládání atomových vrstev vysoce Permitivních izolátorů z prekurzorů na bázi Cyklopentadienylu, 2010, Tartu University Press, p18.,
Citovat tuto Stránku
Pro on-line propojení, prosím, zkopírujte a vložte jeden z následujících postupů:
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium</a>
nebo
<a href="https://www.chemicool.com/elements/hafnium.html">Hafnium Element Facts</a>
citovat tuto stránku v akademickém dokumentu, použijte následující MLA kompatibilní citace:
"Hafnium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/hafnium.html>.