katalyzátor je látka, která urychluje chemickou reakci, ale není spotřebována reakcí; proto katalyzátoru lze obnovit chemicky nezměněna na konci reakce byl použit k urychlení, nebo urychlit.

Diskuse
Pro chemikálie, reagovat, jejich dluhopisy musí být přeskupeny, protože dluhopisy v produktech, které jsou odlišné od těch v reaktantů.,Nejpomalejší krok v přeskupení dluhopisů vyrábí to, co se nazývá přechodový stav – chemické látky, která není reaktant ani produkt, ale je přechodný mezi dvěma.
Energie je zapotřebí k vytvoření přechodového stavu. Tato energie se nazývá aktivační energie nebo Ea.Čtení diagramu níže zleva doprava ukazuje průběh reakce, když reaktanty procházejí přechodovým stavem, aby se staly produkty.,
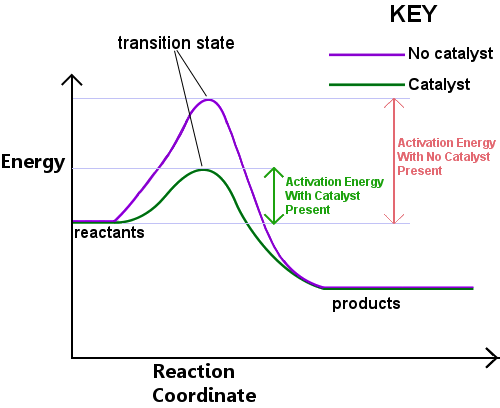
aktivační energie může být považována za překážku chemické reakce, překážku, kterou je třeba překročit.Pokud bariéra je vysoká, několik molekuly dostatečnou kinetickou energii, aby se srazí, tvoří přechod státu, a překonat bariéru.Reaktanty s energií nižší než Ea nemohou projít přechodným stavem, aby reagovaly a staly se produkty.
katalyzátor pracuje tak, že poskytuje jinou cestu, s nižším Ea, pro reakci. Katalyzátory snižují energetickou bariéru.,Různé trasy umožňuje dluhopisů přestavby potřebných k přeměně reaktantů na produkty probíhat snadněji, s nižší vstupní energii.V daném časovém intervalu, za přítomnosti katalyzátoru umožňuje větší část reaktantu druhů vyzvednout dostatek energie, aby se projít přes přechod státu a stát produktů.
Příklad 1: Haberův Proces.
Haberův proces, který se používá k výrobě amoniaku z vodíku a dusíku, je katalyzována železem, které poskytuje atomové místa, na kterém reaktant dluhopisy mohou uspořádat více snadno tvořit přechod státu.,
Příklad 2: Enzymy
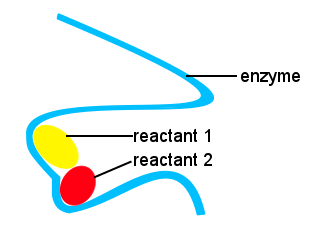
V našem těle, a v jiných živých věcí, enzymy se používají k urychlení biochemických reakcí. Enzym je typ katalyzátoru.Složitý život by byl bez enzymů nemožný, aby reakce probíhaly při vhodných rychlostech.Tvary enzymů spolu s místy na enzymu, které se váží na reaktanty, poskytují alternativní reakční dráhu, což umožňuje, aby se specifické molekuly spojily a vytvořily přechodový stav se sníženou aktivační energetickou bariérou.,
ve schématu níže poskytuje enzym s dlouhým řetězcem místa pro molekuly reaktantu, aby se spojily a vytvořily přechodový stav s nízkou aktivační energií.
Katalyzátory nelze posunout polohu chemické rovnováhy – vpřed a vzad reakce jsou oba zrychlil tak, že rovnovážné konstanty Keq je beze změny.Odstraněním produktů z reakční směsi, jak se tvoří, však lze v praxi zvýšit celkovou rychlost tvorby produktu.